ADA2022: il diario di “bordo” del Dr Andrea Scaramuzza (day 3)
Domenica 5 giugno, terzo giorno di congresso e tradizionalmente il giorno ‘wear red‘, indossa qualcosa di rosso, colore della American Diabetes Association. L’invito è di indossare un capo di abbigliamento di colore rosso per dimostrare il proprio sostegno all’associazione.
Mi ha sempre fatto un po’ invidia questo spirito di squadra che contraddistingue solitamente gli altri Paesi, uniti per un impegno comune (sconfiggere il diabete), quando invece noi ci disperiamo in mille rivoli, che difficilmente avranno di fronte all’opinione pubblica la forza e l’incisività dirompente di un fiume in piena. Ma non è questo né il momento, né il luogo per queste considerazioni.
Oggi altri 66 meeting, addirittura 13 in contemporanea. Le cose più interessanti verranno dalla tecnologia e dall’immunologia, ma cominciamo dando conto di un paio di sessioni di ieri particolarmente interessanti.
Iniziamo con la terapia di rigenerazione beta cellulare. Il simposio si intitolava in maniera assolutamente accattivante: “Beta cell replacement therapy: a pathway to a cure for type 1 diabetes?”
È la strada verso ‘la cura’? Solo il tempo ce lo dirà ma il gioco si fa serio!
È la strada verso ‘la cura’? Solo il tempo ce lo dirà ma il gioco si fa serio!
Quattro oratori di peso, Matthias Hebrok dell’università di California, Andrew Pepper dell’università di Alberta in Canada, Alice Tomei (le cui origini italiane sono evidenti) del Diabetes Research Institute dell’università di Miami (l’Istituto di Camillo Ricordi, per intenderci), e Xunrong Luo del Duke University Medical Center.
La domanda è inevitabile: siamo più vicini a una cura per il diabete tipo 1? La risposta più onestà è: la ricerca è promettente! E non è poco, ve lo garantisco. Quando ho iniziato io ad occuparmi del diabete dei bambini ormai …enta anni fa, una risposta ‘seria’ non c’era nemmeno.
Andrew Pepper sta studiando le possibili vie per la normalizzazione del glucosio (cioè la regolazione della glicemia a un livello normale senza somministrare iniezioni o infondere insulina) e i possibili vantaggi e gli attuali limiti della terapia sostitutiva delle cellule beta.
Sebbene siano stati compiuti molti progressi con il pancreas artificiale (noto anche come sistema di somministrazione di insulina a circuito chiuso o automatizzato), ciò non è sufficiente e quello di cui c’è bisogno è una cura definitiva e radicale che liberi dalla schiavitù di iniezioni e microinfusori.
Una possibilità è la rigenerazione delle cellule beta. Ma ad oggi siamo alla sostituzione beta cellulare. “La terapia sostitutiva delle cellule beta può avere un profondo impatto sul controllo della glicemia.
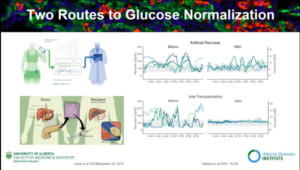
Questi dati mostrano i risultati nove mesi dopo il trapianto (di cellule beta). Il loro funzionamento a lungo termine è realizzabile con la terapia sostitutiva delle cellule beta. Sebbene l’indipendenza dall’insulina diminuisca nel tempo, è comunque possibile ottenere un controllo della glicemia anche a lungo termine, ai pure a spesa di continuare a provvedere le cellule beta necessarie.
Il dottor Pepper ha fatto una relazione sullo stato dell’arte della terapia di sostituzione, sottolineandone in particolare i limiti. Solo il 5-10% degli individui con diabete tipo 1 rispecchiano i criteri di selezione attualmente in uso, molto selettivi, in quanto, alla fine quello di cui non si può fare a meno è la terapia immunosoppressiva.
Guardando alle limitazioni verrebbe da dire che la terapia di sostituzione delle beta cellule ci fa essere così vicini alla soluzione e allo stesso tempo così lontani. Ciò che sappiamo infatti è che la maggior parte delle isole viene distrutta ore o pochi giorni dopo il trapianto. Stando così le cose è necessario disporre di donatori multipli per singolo ricevente per raggiungere il controllo della glicemia e l’insulinoindipendenza. E questo comunque comporta farmaci anti-rigetto da assumere per tutta la vita.
Nonostante il grande lavoro fatto, il campo è ancora limitato a causa di una fonte limitata di materiale necessario (cellule beta trapiantabili) e del bisogno permanente di immunosoppressione.
Tuttavia, Pepper ha evidenziato alcune aree chiave di ricerca:
1) Uno dei progressi attuali riguarda sorgenti cellulari illimitate. Lo xenotrapianto ha avuto successo nei suini. Gli xenotrapianti di cuore e reni sono già stati eseguiti con successo.
2) Anche la terapia con cellule staminali è promettente. Pepper ha raccontato l’entusiasmante ricerca di ViaCyte. Ad oggi gli unici ad avere “le prime e uniche terapie sostitutive delle cellule insulari derivate da cellule staminali negli studi clinici per il diabete”.
3) Il lavoro di Vertex, il trapianto di cellule SC-beta nel fegato, ha avuto un impatto significativo anche sui primi pochi pazienti trattati con questa tecnica. Di recente, un individuo trattato ha abbandonato l’insulina utilizzando questo approccio.
Tuttavia, tutti questi approcci hanno un problema in comune: la necessità di un’immunosoppressione sistemica permanente. E mentre vale la pena celebrare i progressi nella cura del diabete di tipo 1 di qualsiasi tipo, i farmaci immunosoppressori rappresentano ancora una minaccia anche a causa di molti effetti collaterali significativi, che dovrebbero essere evitati:
• Perdita di appetito • Nausea e vomito • Aumento della crescita dei capelli • Mano che trema • Aumento del rischio di infezione • Aumento della fatica, debolezza o stanchezza • Febbre e brividi • Minzione frequente o sensazione di bruciore durante la minzione • Un raffreddore o tosse ricorrente senza tregua.
• Perdita di appetito • Nausea e vomito • Aumento della crescita dei capelli • Mano che trema • Aumento del rischio di infezione • Aumento della fatica, debolezza o stanchezza • Febbre e brividi • Minzione frequente o sensazione di bruciore durante la minzione • Un raffreddore o tosse ricorrente senza tregua.
È importante sapere dove sta andando la ricerca, ma anche avere una prospettiva da dove siamo partiti e cosa abbiamo imparato lungo la strada.
L’avvento dell’incapsulamento negli anni ’70 ha portato a un aumento vertiginoso delle tecniche di incapsulamento, usando isole incapsulate in grado di regolare la glicemia, ad oggi però senza grandi successi.
I nuovi materiali usati per incapsulare potrebbero però risultare più efficaci e si aspetta con ansia l’esito degli studi di validazione.
Sebbene questi tentativi ad oggi non abbiano ancora aperto la strada ad una cura definitiva, ci si avvicina sempre un pochino di più. I problemi da superare restano comunque la immunosoppressione e la capacità di ossigenata le cellule beta, passaggio sicuramente cruciale se si vorrà mettere a punto una tecnica vincente.
Mi discosto ora dai miei pallini abituali perché alcune presentazioni ieri hanno monopolizzato l’attenzione di molti e non solo degli addetti ai lavori in senso stretto, per intenderci chi si occupa di diabete tipo 2.
Mi riferisco a Tirzepatide, approvato da FDA il 13 maggio e che si appresta a sbarcare anche da noi, di cui sono stati presentati i dati degli studi principali che lo hanno visto coinvolto.
Si tratta di un farmaco per il diabete tipo 2 e per l’obesità. Mounjaro, questo dovrebbe essere il nome commerciale dovrebbe essere usato non solo per i pazienti con diabete tipo 2 ma anche per gli obesi e per le persone con diabete tipo 1 e obesità (che purtroppo non sono pochissime).
“È facile perdere peso come lo è sempre stato per me aumentare di peso”, ha detto un partecipante allo studio. Questa affermazione riassume il potenziale della capacità di Mounjaro di aiutare le persone che convivono con obesità e diabete di tipo 2 in tutto il mondo.
Mounjaro (Tirzepatide) è un farmaco iniettabile una volta alla settimana di Lilly Diabetes. È il primo e unico agonista del doppio recettore GIP/GLP-1 unimolecolare:
1) polipeptide insulinotropico glucosio-dipendente (GIP)
2) peptide-1 simile al glucagone (GLP-1)
Ha dimostrato di comportare riduzioni significative dei livelli di glicata e del peso corporeo. Mounjaro funziona in diversi modi:
1) Aumenta la produzione di insulina, ma solo quando la glicemia aumenta, il che riduce al minimo il rischio di ipoglicemia.
2) Riduce la produzione di zucchero da parte del fegato.
3) Rallenta la velocità con cui lo stomaco svuota il cibo nell’intestino. Questo aiuta a gestire i livelli di zucchero nel sangue dopo aver mangiato, lasciandoti anche pieno più a lungo.
1) Aumenta la produzione di insulina, ma solo quando la glicemia aumenta, il che riduce al minimo il rischio di ipoglicemia.
2) Riduce la produzione di zucchero da parte del fegato.
3) Rallenta la velocità con cui lo stomaco svuota il cibo nell’intestino. Questo aiuta a gestire i livelli di zucchero nel sangue dopo aver mangiato, lasciandoti anche pieno più a lungo.
SURMOUNT-1 è il primo studio di fase 3 (quella che appunto precede la commercializzazione) di cui sono stati presentati i dati.
2539 partecipanti, 105 kg il peso medio. Alla dose più bassa di 5 mg, i pazienti hanno perso il 15% del peso in 72 settimane. Aumentando la dose a 10-15 mg il peso perso è stato il 20% (più della metà di coloro che hanno assunto la dose massima ha perso il 20% del peso rispetto a solo 1.3% di chi ha assunto placebo).
2539 partecipanti, 105 kg il peso medio. Alla dose più bassa di 5 mg, i pazienti hanno perso il 15% del peso in 72 settimane. Aumentando la dose a 10-15 mg il peso perso è stato il 20% (più della metà di coloro che hanno assunto la dose massima ha perso il 20% del peso rispetto a solo 1.3% di chi ha assunto placebo).
Il 22.5% ha perso circa 24 kg e oltre il 57% ha mantenuto il peso perso durante le 72 settimane di osservazione, migliorando tutti i parametri cardiometabolici, compresi pressione arteriosa, trigliceridi, BMI, glicata e colesterolo.
Oltre il 95% di chi aveva un prediabete ha normalizzato la glicemia, riducendo la secrezione di insulina e riducendo la circonferenza addominale.
Rispetto a qualsiasi altro farmaco finora utilizzato, Mounjaro si è rivelato essere il farmaco più efficace per la perdita di peso. In particolare, rispetto a Semaglutide l’efficacia sembra maggiore e soprattutto più duratura. Addirittura sembra più efficace nella perdita di peso rispetto alla chirurgia bariatrica.
Anche per Mounjaro, almeno per alcuni pazienti, la dose di mantenimento sembra indispensabile per mantenere il calo di peso.
Ovviamente ogni medaglia ha il suo rovescio, e anche Tirzepatide ha gli effetti collaterali di farmaci simili, in particolare sintomi digestivi, e soprattutto nelle prime settimane di trattamento. Tali effetti tendono a diminuire fino a sparire una volta raggiunto il dosaggio efficace.
Fra gli effetti indesiderati più comuni, nausea, diarrea, stipsi, dispepsia, vomito, riduzione dell’appetito (non lo considererei proprio un effetto collaterale!), dolori addominali, eruttazione. Meno frequenti cefalea, perdita di capelli, reazione nel sito di iniezione, stordimento.
Notizia molto interessante, la possibilità di utilizzare Tirzepatide anche negli adolescenti con diabete tipo 2. Infatti, è attualmente in corso uno studio per valutarne efficacia e sicurezza in questa fascia di età.
Interessante anche il dibattito emoglobina glicata vs. time in range. Probabilmente (questo è il mio parere) sono complementari e non si escludono a vicenda. Questo è anche il parere di Irl Hirsch che ha presentato anche un indice più complesso e completo, il Glycemic Risk Index, GRI. Ve ne parlerò più avanti, ma mi fa piacere anticipare che applicato ai nostri ragazzi (i partecipanti ad alcuni studi che stiamo portando avanti), la quasi totalità si trova in un zona di assoluta sicurezza o quasi rispetto a ipoglicemie severe e chetoacidosi.
Oggi si è parlato, fra l’altro, di gestione della glicemia postprandiale. Numerosi studi, infatti, attribuiscono ad una cattiva gestione di questo momento le premesse per un controllo scadente della glicemia.
Satish Garg, professore di Medicina e Pediatria all’università del Colorado a Denver e Editor in chief della rivista Diabetes Technology and Therapeutics ha raccontato come le nuove tecnologie, CGM e sistemi ibridi innanzitutto abbiano confermato l’importanza di gestire il periodo postprandiale, per migliorare il compenso generale e ridurre così facendo complicanze a lungo termine.
L’approccio tradizionale per la gestione della glicemia postprandiale si concentra sui macronutrienti come carboidrati, grassi e proteine, ha affermato la dottoressa Willis. Decenni di ricerca sono stati dedicati al conteggio dei carboidrati e all’adeguamento del dosaggio prandiale di insulina per tenere conto del picco di glicemia stimato. Più recentemente, le linee guida e le raccomandazioni nutrizionali dell’ADA si sono concentrate sulle strategie di dosaggio dell’insulina per tenere conto dell’impatto di proteine e grassi sui picchi postprandiali.
Il messaggio su come dosare l’insulina per pasti ricchi di grassi e proteine è importante. Ma, in un certo senso, manca il quadro generale, che potrebbe trarre vantaggio dal concentrarsi sui modi per aiutare le persone a migliorare la qualità della loro dieta generale.
Non esiste uno schema alimentare perfetto che ogni persona che convive con il diabete dovrebbe seguire, ha detto la dottoressa Willis. Ma ci sono pilastri nutrizionali che dovrebbero guidare qualsiasi modello alimentare: mangiare più cibi integrali, più verdure non amidacee, limitare i cereali raffinati e gli zuccheri aggiunti, ridurre gli alimenti trasformati e confezionati. Ognuno di questi comportamenti migliorerà quasi tutti i modelli alimentari.
Sia oggi che nei giorni scorsi, si è parlato anche molto di equità.
Equità nelle cure, ma anche nella rappresentazione delle minoranze negli studi clinici, per valutare con cognizione gli effetti di questo o quel farmaco, di questa o quella tecnologia non solo nella maggioranza dei pazienti, ma in tutti, ivi compresi i pazienti LBGQT, ovviamente presenti fra i pazienti così numerosi di un malattia quale il diabete è.
Equità nelle cure, ma anche nella rappresentazione delle minoranze negli studi clinici, per valutare con cognizione gli effetti di questo o quel farmaco, di questa o quella tecnologia non solo nella maggioranza dei pazienti, ma in tutti, ivi compresi i pazienti LBGQT, ovviamente presenti fra i pazienti così numerosi di un malattia quale il diabete è.
Si è parlato di educazione quale strategia vincente per rendere più efficace la tecnologia anche fra le minoranze o i gruppi di etnia differente. E non potrei essere più d’accordo.
Dispositivi high-tech come microinfusori e monitor continui della glicemia (CGM) possono essere strumenti efficaci per aiutare i pazienti con diabete a gestire la glicemia. Ma l’accesso a queste tecnologie, così come l’istruzione e il supporto necessari per utilizzarle con successo, rimane una sfida per i pazienti nelle comunità con risorse insufficienti.
Fra le barriere riconosciute ci sono ad esempio la possibilità di avvalersi o meno di un assicurazione privata, della tecnologia stessa e del background culturale. Educare significa, in parte, superare queste barriere, o almeno alcune di esse.
Domani parleremo di G7, Omnipod 5, intercomunicabilità, tecnologia nei più giovani. Nel frattempo buonanotte a tutti. E grazie per i ripetuti apprezzamenti. In realtà è un modo utile per fare chiarezza e focalizzarsi sugli aspetti più interessanti.
Dr Andrea Scaramuzza
Responsabile Endocrinologia, Diabetologia & Nutrizione Pediatrica presso ASST di Cremona
Responsabile Endocrinologia, Diabetologia & Nutrizione Pediatrica presso ASST di Cremona







